
En la Tierra, lo habitual es encontrar la materia en alguno de los estados más conocidos: sólido, líquido o gaseoso.
En el Universo sin embargo la mayor parte de la materia está en forma de plasma, que es un estado especial gaseoso a alta temperatura en el que los átomos han perdido todos los electrones convirtiéndose por tanto en núcleos atómicos cargados. Otros estados de la materia más complejos, de los que sabemos poco, son la materia que compone la estrella de neutrones o los agujeros negros.
El estado sólido.
Este estado de la materia se caracteriza porque las partículas físicas que lo componen
(átomos, moléculas o iones) mantiene posiciones relativas definidas en el espacio debido a la elevada magnitud de la fuerza que las une. Las partículas vibran pues constantemente en torno a posiciones fijas de equilibrio por lo que un aspecto esencial del estado sólido es el tener forma y volumen constante. También, por la misma razón, será difícilmente compresible (en la práctica no lo es).
La estructura de los sólidos puede ser muy diferente dependiendo de que sus partículas sean átomos, moléculas no polares, moléculas polarizadas o iones. La diferencia en uno u otro depende de la naturaleza de los enlaces que se puedan crear en cada caso.
Estas uniones condicionan las propiedades básicas por las que los conocemos: dureza, conductividad, ductilidad, maleabilidad, elevados o bajos puntos de fusión y ebullición....
El estado líquido.
En el estado líquido las fuerzas de cohesión intermolecular son suficientemente fuertes como para mantener unidas las moléculas (están ligeramente separadas), pero la intensidad de la fuerza no es lo suficiente como para que las moléculas permanezcan en posiciones relativas constantes (estado sólido), es decir, las moléculas pueden moverse con una libertad que depende de la naturaleza de cada sustancia. Cuanta menor es esa libertad decimos que el líquido (fluido) es más "viscoso". Debido a esta situación y a la fuerza de gravedad los líquidos adoptan la forma del recipiente que los contiene teniendo volumen propio. Dado que la separación intermolecular es muy baja los líquidos son incompresibles.
- Viscosidad: resistencia de un fluido al movimiento debido al rozamiento interno molecular.
- Fluidez: magnitud que expresa la facilidad de las partículas de un fluido para deslizarse unas sobres otras (inverso de la viscosidad).
 |
| En la animación, el fluido de abajo es más viscoso que el de arriba o el fluido de arriba tiene mayor fluidez. |
- Tensión superficial: energía que se requiere para extender o aumentar la superficie de un líquido por unidad de área.

El estado gaseoso.
Se denomina gas el estado de agregación de la materia que bajo ciertas condiciones de temperatura y presión permanece en estado gaseoso. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Existen diversas leyes derivadas de modelos simplificados de la realidad que relacionan la presión, el volumen y la temperatura de un gas:
- Ley de Charles
A una presión dada, el volumen ocupado por una cierta cantidad de un gas es directamente proporcional a su temperatura.Matemáticamente la expresión sería:
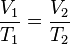 o
o  .
.- Ley de Gay-Lusac
La presión de una cierta cantidad de gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura.

- Ley de los gases ideales
Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:
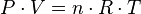
Siendo P la presión, V el volumen, n el número de moles, R la constante universal de los gases ideales y T la temperatura en Kelvin. El valor de R depende de las unidades que se estén utilizando.
Estas ideas son recogidas por la teoría cinético-molecular que expresa que los gases están constituidos por moléculas que se mueven libremente por el espacio. La velocidad media de las moléculas la identificamos como temperatura y los impactos de las moléculas sobre los objetos como presión. Ya que la atracción intermolecular es muy pequeña un gas ocupará todo el volumen de que disponga.
Si aumenta el volumen a temperatura constante cabrán menos moléculas por unidad de volumen y por tanto la presión será menor. Si se aumenta la temperatura de una gas a volumen constante, los impactos de las moléculas sobre los objetos transmitirán mayor energía por lo que la presión aumentará.
No hay comentarios:
Publicar un comentario