
Cuando dos átomos interaccionan par producir moléculas u otros entes, la interacción es siempre a través de los electrones más extensos de los mismos, es decir, el último nivel.
Las fuerzas que se ponen de manifiesto en las interacciones atómicas se denominan fuerzas de afinad química. De hecho, el número de electrones de la última capa y la fuerza con que están ligados al átomo son las características básicas que van a decidir el tipo de átomo y por tanto cómo se unirá a otros. Por consiguiente, se podrá deducir las propiedades químicas y físicas de macroscópicas de la sustancia resultante.
Los átomos se unen porque de esa forma adquieren mayor estabilidad, ya que la última capa de cualquier elemento (a excepción del H y He) es capaz de contener un máximo de ocho electrones resultando ser la misma configuración que la de los gases nobles. Esta configuración electrónica es extremadamente estable y es la causa de la poca reactividad de los gases nobles que suelen encontrarse como átomos aislados. Por ello todos los elementos tienden a completar su última capa, bien perdiendo, ganando o compartiendo electrones con otros átomos.
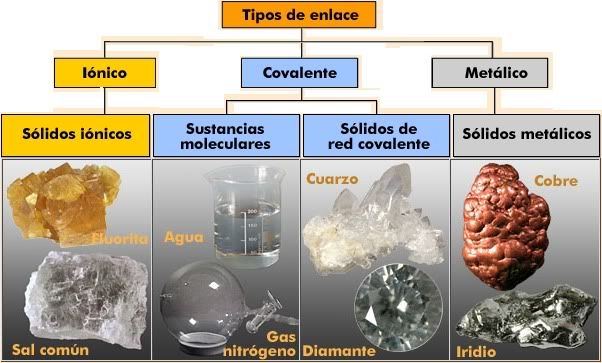
Existen tres principales enlaces químicos que condicionan las propiedades de las sustancias, permitiendo clasificarlas por sus enlaces:
- Enlace covalente: enlace en el que dos átomos, de electronegatividad parecida, comparten dos electrones.
- Sustancias moleculares. Prácticamente todas las sustancias que son gases o líquidos a 25 ºC y a la presión normal son moleculares. La debilidad de las fuerzas de atracción entre las moléculas que componen estas sustancias hace que se necesite poca energía para separarlas por lo que presentan bajos puntos de fusión y de ebullición
- Sólidos de red covalente: Los átomos que forman estas sustancias están unidos por una red continua de enlaces covalentes, formando lo que se denomina una red cristalina, que hace que presenten estas propiedades
- Son muy duros.
- Tienen elevado punto de fusión
- Son insolubles en todos los disolventes comunes
- Son malos conductores de la electricidad
- Enlace iónico: enlace en el que dos átomos de muy diferente electronegatividad se unen debido a fuerzas electrostáticas.
- Sólidos iónicos:
- No son volátiles y tienen un punto de fusión alto.
- Los sólidos iónicos no conducen la electricidad. Sin embargo, llegan a ser buenos conductores cuando están fundidos o disueltos en agua
- Muchos compuestos iónicos, pero no todos, son solubles en agua.
- Enlace metálico: es un tipo de enlace covalente que se produce entre átomos con los electrones de la última capa sujetos débilmente Cuando existen muchos átomos juntos los electrones externos, en su movimiento, pueden llegar a pertenecer a su átomo o al vecino.
- Sólidos metálicos.
- Conductividad eléctrica elevada
- Buenos conductores del calor.
- Ductilidad y maleabilidad
- Insolubilidad en agua y en otros disolventes comunes
En el siguiente enlace se explican los distintos enlaces que se producen (covalente, metálico e iónico) junto con simulaciones de los mismos: Enlaces químicos
No hay comentarios:
Publicar un comentario